■変更申請(本学の臨床試験審査委員会で審査)のフロー
■変更申請(本学の臨床試験審査委員会で審査)の手続き ▼クリックで展開
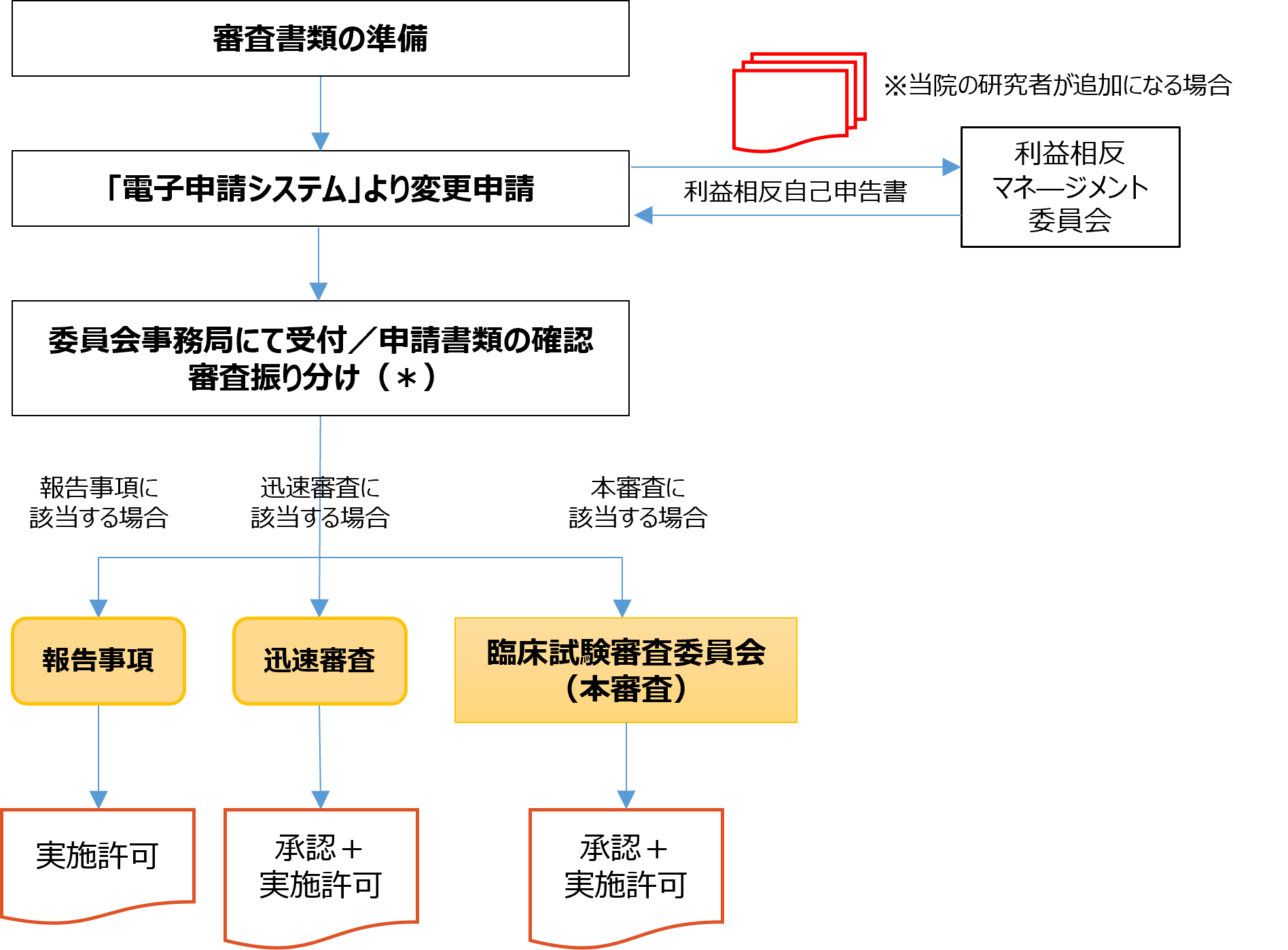
1.審査書類の準備
変更となる該当書類の準備(新旧対照表も併せて準備すること)
※他機関の研究者が研究代表者となる多機関共同研究(個別審査)の場合
代表機関において承認された審査結果通知書及び審査資料一式
2.電子申請システムより申請
(1)電子申請システムより、該当書類を添付し変更申請
※他の機関の研究責任者・研究分担者の変更の場合は、変更点は「その他変更」を選択してください。
(2)利益相反の自己申告(当院の研究者の追加がある場合のみ)
・電子申請システムで利益相反自己申告書を入力後、印刷し署名の上、原本を臨床試験係に提出。
・臨床試験係より利益相反マネージメント委員会による確認を依頼。
(3)委員会事務局にて受付/申請書類の確認
委員会事務局にて申請書類を確認し、変更内容により、審査方法(「本審査」「迅速審査」「報告事項」)を決定。
3.委員会審査の振り分け
(1)本学のみで実施する単機関研究/本学の研究責任者が研究代表者となる多機関共同研究の場合
研究計画の軽微な変更に該当する場合は、迅速審査もしくは報告事項にて対応。
(<迅速審査・報告事項の対応について>参照)
それ以外は、本審査で審議を行う。
「報告事項」に該当する場合は、事務局確認の後、病院長の実施許可を得た上で、「実施許可通知書」を通知。
※「報告事項」については、新指針に基づき実施する研究の場合のみ対応。
(2)他機関の研究者が研究代表者となる多機関共同研究に参加する場合(個別審査)
代表機関において既に承認を得ているため、基本的に迅速審査を行います。
<迅速審査・報告事項の対応について>
①研究課題名の追加・変更
②研究実施期間の変更(1年を超えるものを除く。) ③研究責任者・研究分担者・研究協力者等の職名及び氏名の変更
④研究分担者,研究協力者等の変更
⑤共同研究機関の変更 ⑥実施症例数の変更(本院が代表機関となる研究の研究全体の症例数の変更を除く。) ⑦誤字脱字又は表現の修正,その他の記載整備 ⑧委員会からの明確な指示に従った研究計画書、説明文書等の変更 ⑨その他委員長が軽微と認めるもの
そのうち、①③⑦⑨については、報告事項とし、委員会事務局で確認することで承認を得たものといたします。
4.承認後の実施許可
承認となった場合、「審査結果通知書」とともに「実施可否通知書」が発行されます。
■本学の研究者が研究代表者となる多機関共同研究の場合
研究代表者は、各研究責任者に、審査結果通知書、審査資料一式、審査過程のわかる記録及び当該倫理審査委員会の委員の出欠状況(代表者から共有)を送付。各機関にて実施許可を取得。
■他機関の研究者が研究代表者となる多機関共同研究(個別審査)の場合
研究代表者に審査結果及び実施許可取得について報告。
■申請書類
・本学のみで実施する単機関研究/本学の研究責任者が研究代表者となる多機関共同研究の場合
|
審査書類
|
様式
|
|
臨床研究変更申請書(電子申請システムで作成・提出不要)
|
別紙様式4
|
|
変更該当書類
|
ー
|
|
変更該当書類の新旧対照表
|
任意
|
・本学が多機関共同研究に参加(個別審査)している場合
|
審査書類
|
様式
|
|
臨床研究変更申請書(電子申請システムで作成・提出不要)
|
別紙様式4
|
|
研究計画書及び説明同意文書の変更の場合は、代表機関において承認された審査結果通知書及び審査資料一式
|
-
|
|
本学研究分担者リスト(変更がある場合)
|
別紙様式2
|
|
本院で使用する説明同意文書(変更がある場合)
|
-
|

