代表機関において本学以外の倫理審査委員会に一括審査を行う臨床研究に参加する場合は、本学の倫理審査委員会での審査は不要ですが、実施許可の申請は必要となります。
■新規申請の手続き
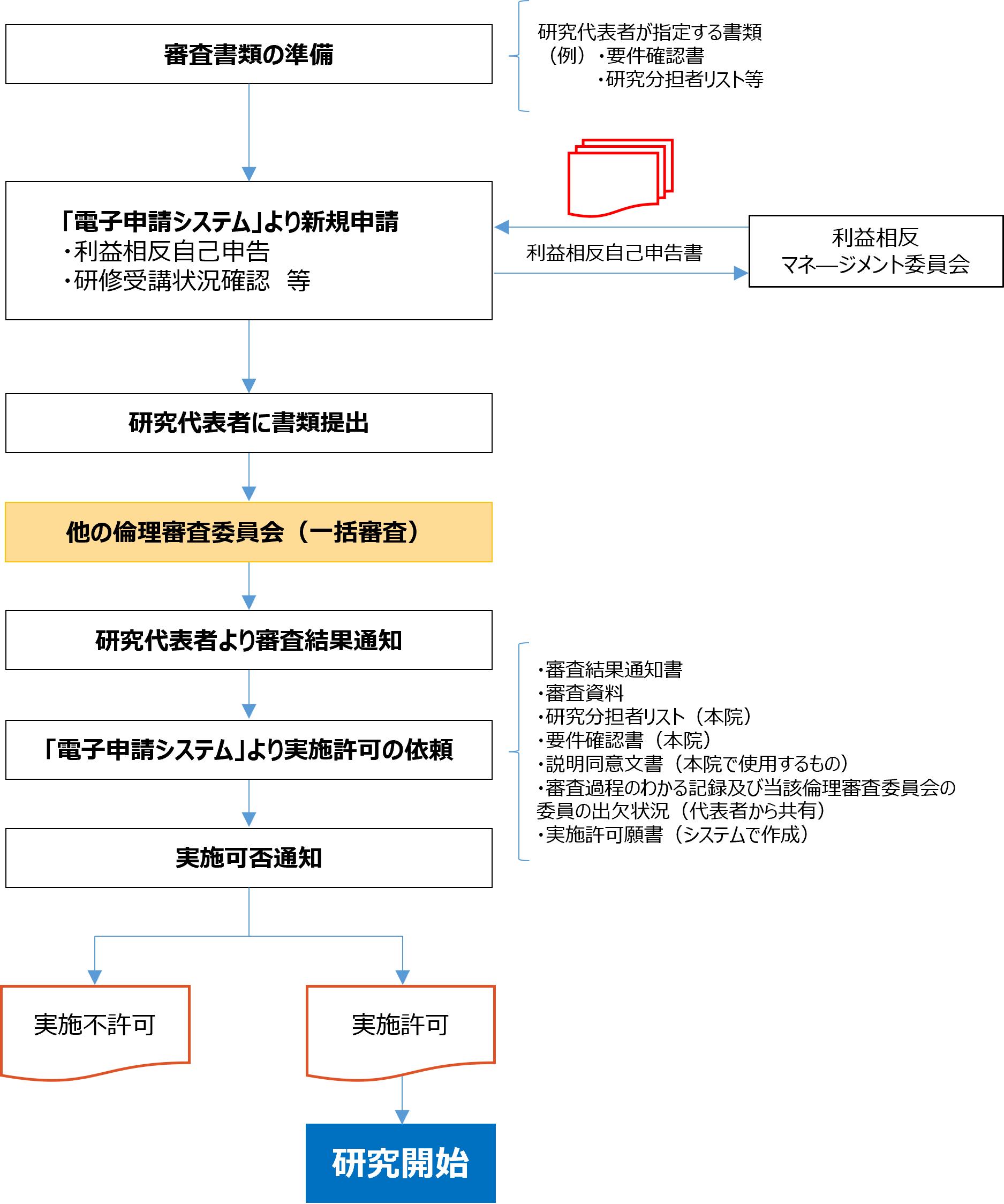
研究への参加が決定したら、研究代表者に一括審査を依頼する前に、まずは臨床試験審査委員会への新規申請と同様、電子申請システムに分かっている範囲で入力し一時保存してください。また、研究責任者及び研究分担者については、各自、利益相反自己申告書の入力をお願いいたします。本学の研究実施体制(研究責任者・研究分担者)、利益相反申告状況、研修受講状況を事務局で確認いたします。確認後、研究代表者に一括審査を依頼してください。
一括審査が終わりましたら、研究代表者から共有された審査結果通知書・審査書類一式を電子申請システムにアップロードし、病院長の実施許可の申請を行ってください。
(注)本学の倫理審査委員会での審査は不要ですが、実施許可の申請は必要となります。
■臨床試験審査委員会申請から研究開始までのフロー
■臨床試験審査委員会申請から研究開始までの手続き ▼クリックで展開
■申請書類
|
書類名 |
様式 |
|
代表機関において承認された審査結果通知書及び審査資料一式 |
- |
|
審査過程のわかる記録及び当該倫理審査委員会の委員の出欠状況(代表者から共有) |
- |
|
説明同意文書(本学で使用するもの)(*) |
- |
|
本学研究分担者リスト |
|
|
要件確認書(本学) |
- |
|
実施許可願書(システムで作成・提出不要) |
別紙様式11 |
(*)責任者、連絡先、同意文書の宛名等、本学で使用する内容に修正したもの(word文書)を添付願います。事務局にて電子カルテに取り込むためのQRコード表示等の記載整備を行います。
word文書での入手が困難な場合もしくは編集が不可の場合は、代表機関で作成のもののみ添付願います。
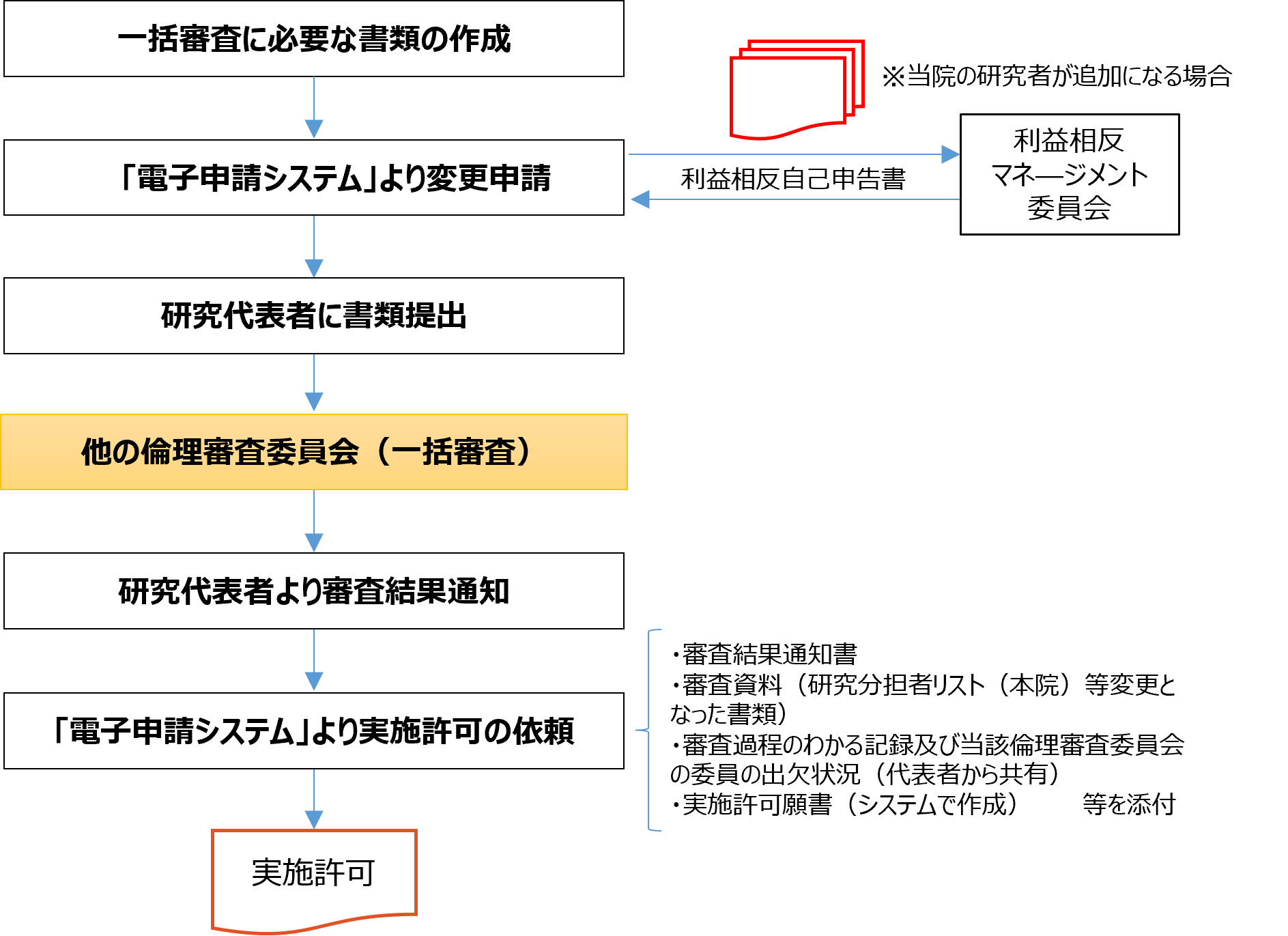
■変更申請時の手続き
■変更申請(他の倫理審査委員会で一括審査)の手続き ▼クリックで展開
■申請書類
|
審査資料 |
様式 |
|
■本院の研究責任者が作成 |
|
|
臨床研究変更申請書(電子申請システムで作成・提出不要) |
別紙様式4 |
|
代表機関において承認された審査結果通知書及び審査資料一式 |
- |
|
研究分担者リスト(当院の実施体制が変更となる場合) |
|
|
本院で使用する説明同意文書(説明同意文書の変更の場合 |
- |
