臨床研究の計画立案から倫理審査委員会への申請までの手続について記載します。
1.研究計画の立案
研究デザイン、評価項目、研究実施体制等を計画します。
研究計画立案にあたり、アドバイス・支援が必要な場合、まずは各診療科等の研究医長へご相談ください。
また、当センターのスタッフが研究支援(研究デザイン相談、実施計画書等作成支援、統計解析、CRC業務 等)を行っております。
当センターのスタッフによる研究支援をご希望の方は、下記を参照願います。
研究計画立案にあたり、ご不明な点がございましたら、下記フォームよりお問合せください。
2.倫理審査委員会への申請準備
(1)金沢大学における臨床研究の倫理審査体制について
研究の種類により、遵守する法・指針、申請先の倫理審査委員会が異なります。(下表参照)
該当の倫理審査委員会のWebサイトにて、スケジュール、必要書類一式等をご確認の上、申請書類をご準備ください。
■当院の倫理審査体制
| 研究の種類 | 法・指針 | 倫理審査委員会 | 担当事務 | ||
|---|---|---|---|---|---|
|
医薬品等の臨床研究
|
治験 | 承認申請目的の医薬品等の臨床試験 | 医薬品医療機器等法 | 金沢大学附属病院受託研究審査委員会(IRB) | 先端医療開発センター・臨床研究管理事務局 (内線2090) |
| 特定臨床研究 | 未承認・適応外の医薬品等の臨床研究 | 臨床研究法 | 金沢大学臨床研究審査委員会(CRB) | 病院部経営管理課臨床試験係 (内線2048・2072) |
|
| 製薬企業等から資金提供を受けた医薬品等の臨床研究 | |||||
|
特定臨床研究以外の臨床研究(努力義務研究) ・研究目的で医薬品等を使用する場合 ・通常の医療の提供として医薬品等を使用する場合で研究目的で研究対象者に著しい負担を与える検査等を通常の医療に追加して行うもの ・適応外使用のうち薬事承認済みの用法等と同程度以下のリスクのもの |
|||||
| 手術・手技の介入研究 侵襲的研究 |
人を対象とする生命科学・医学系研究に関する倫理指針 | 金沢大学附属病院臨床試験審査委員会(CTRB) | |||
| 一般の医療(いわゆる観察研究) 看護・保健指導やリハビリなどの介入研究 非侵襲的研究(軽微な侵襲含む) |
金沢大学医学倫理審査委員会 | 医薬保健系事務部総務課 (内線2110・2834) |
|||
| ヒトゲノムや遺伝子の構造解析 | 金沢大学ヒトゲノム・遺伝子解析研究倫理審査委員会 | ||||
※侵襲・介入の定義と事例については、こちらをご覧ください。
<参考>委員会判定フローチャート
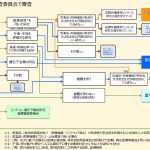
★申請先の倫理審査委員会の判断に迷う場合は、問合せフォームよりご相談ください。
(2)代表機関で一括倫理審査を行い、本学の実施許可書の発行が必要な場合の申請について
電子申請システムの新規申請メニューより、「他の倫理審査委員会で審査」を選択し、ガイダンスに従って申請を行ってください。(詳細は下記のフローチャートをご覧ください。)
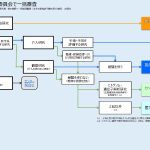
3.倫理審査委員会への申請
申請書類が整いましたら臨床研究電子申請システムより申請を行ってください。
※治験の申請につきましては、こちらを参照願います。
(注)電子申請システムでは、新規申請時にガイダンスに従って進めると該当の倫理審査委員会が指定されます。
(注)臨床研究電子申請システムのユーザ登録が未登録の方は、ユーザ登録が必要となります。詳細はこちらをご覧ください。
個別症例に対する適応外医薬品等の使用について
国内未承認医薬品・医療機器の臨床使用または医薬品・医療機器の適応外使用を診療目的で実施する場合の手続きは、以下のとおりです。
■臨床研究として実施する場合
→ 特定臨床研究のページをご覧ください。
■治療目的の場合
→ 金沢大学附属病院高難度新規医療技術等を用いた医療の提供について
高難度新規医療技術及び未承認新規医療品等を用いた医療を提供する際の申請については、
病院部医事課医療安全係(内線2091)へご連絡ください。
